Glutensensitivität
Als Glutensensitivität (GS) (auch engl. Gluten Sensitivity, Non Celiac Gluten Sensitivity, „Glutenunverträglichkeit“ genannt) wird eine Reihe von als negativ empfundenen Symptomen bezeichnet, die mit der Aufnahme von Gluten in Verbindung gebracht werden, auch wenn keine zöliakiespezifischen Antikörper vorhanden sind und eine klassische Atrophie der Darmzotten in Verbindung mit Zöliakie ausgeschlossen werden kann. HLA-Status und das Auftreten von Anti-Gliadin-Antikörpern (AGA) der ersten Generation sind dabei variabel. Um eine Verwechslung mit Zöliakie zu vermeiden, die manchmal auch als glutensensitive Enteropathie bezeichnet wird, wird die Bezeichnung „Non Celiac Gluten Sensitivity“ (NCGS, nicht-zöliakische Glutensensitivität) als neue Definition eingeführt.[1] Ob die Symptome tatsächlich durch Gluten ausgelöst werden oder statt dessen andere Inhaltsstoffe wie FODMAPs oder der Nocebo-Effekt die Ursache sind, ist in der Fachwelt umstritten.[2][3][4]
Zu den einer Glutensensitivität zugeschriebenen Symptomen zählen Blähungen, abdominale Beschwerden, Schmerzen oder Durchfall; es können aber auch zahlreiche extraintestinale Symptome einschließlich Kopfschmerzen und Migräne, Lethargie und Müdigkeit, Aufmerksamkeitsdefizitstörungen und Hyperaktivität, Schizophrenie, Muskelbeschwerden sowie Knochen- und Gelenksschmerzen auftreten.[5][6][7][8] Bis vor kurzem wurden die Begriffe Glutensensitivität und Zöliakie in der Literatur synonym verwendet. Doch aus jüngsten Untersuchungen lassen sich erste Unterschiede zwischen Zöliakie und Glutensensitivität ableiten.
Gluten ist ein Stoffgemisch aus Proteinen, das in Nahrungsmitteln vorkommt, die aus Weizen und ähnlichen Getreidearten hergestellt werden, darunter auch Gerste und Roggen. Es macht den Teig geschmeidig und sorgt dafür, dass er aufgeht und seine Form behält. Gluten ist in vielen Hauptnahrungsmitteln der westlichen Kost enthalten. Es besteht aus einer Gliadin-Fraktion (in Alkohol löslich) und einer Glutenin-Fraktion (nur in verdünnten Säuren oder im Alkalischen löslich).
Inhaltsverzeichnis
[Verbergen]- 1 Symptome
- 2 Ätiologie
- 3 Ursachen für die Glutensensitivität
- 4 Unterscheiden verschiedener Formen von Glutensensitivität
- 5 Glutensensitive Enteropathie (GSE)
- 6 Idiopathische Glutensensitivität
- 7 Glutenallergiebedingte Sensitivitäten
- 8 Vergleichende Pathophysiologie
- 9 Glutenquellen
- 10 Einzelnachweise
Symptome[Bearbeiten]
Zu den Symptomen der Glutensensitivität können Blähungen, abdominelle (= den Bauch betreffende) Beschwerden, Schmerzen oder Durchfall zählen; es können aber auch zahlreiche extraintestinale (= außerhalb des Darms auftretende) Symptome einschließlich Kopfschmerzen und Migräne, Lethargie und Müdigkeit, Aufmerksamkeitsdefizitstörungen und Hyperaktivität, Muskelbeschwerden sowie Knochen- und Gelenksschmerzen auftreten.[7][8][9]
Diagnose der Glutensensitivität[Bearbeiten]
Wenn aufgrund der Krankengeschichte eines Patienten sowie klinischen Untersuchungen Zöliakie und Weizenallergie ausgeschlossen werden können, sollte die Diagnose Glutensensitivität in Betracht gezogen werden. Bevor sich die Diagnose Glutensensitivität erhärten lässt, müssen jedoch folgende Kriterien zutreffen:
- Eine Weizenallergie wurde ausgeschlossen (Anti-IgE-Antikörper-negativ).
- Eine Zöliakie wurde ausgeschlossen (negatives serologisches tTG/EMA/dAGA-Ergebnis und IgA-Defizienz).
- Es liegt keine HLA-Einschränkung vor. Durch das Fehlen von HLA DQ2/8-Heterodimer kann eine Zöliakie praktisch ausgeschlossen werden; es ist jedoch auch wichtig zu beachten, dass das Vorliegen von HLA DQ 2 oder DQ8 nicht zwangsläufig eine Zöliakie bedeutet.
- Eine Darmbiopsie ergibt keine Zottenatrophie (Marsh-Klassifizierung III), doch können geringfügige Veränderungen der Darmschleimhaut vorliegen (Marsh-Klassifizierung 0–I).
- Das mögliche Vorliegen der Anti-Gliadin-Antikörper (AGA) IgA und/oder IgG im Serum wurde untersucht.
- Der Patient stellt bei einer glutenfreien Diät eine Linderung der Symptome fest.
Wenn die oben genannten Kriterien zutreffen, kann die Person als „glutensensitiv“ eingestuft und über eine bestimmte Zeit mit einer glutenfreien Diät behandelt werden. Dies sollte die Symptome beseitigen.
Der Unterschied zwischen Glutensensitivität und Zöliakie[Bearbeiten]
Während die Forschung im Bereich der Glutensensitivität noch relativ am Anfang steht, ist die Zöliakie dagegen ein gut definiertes Krankheitsbild. Es handelt sich dabei um eine lebenslange Autoimmunerkrankung in Form einer chronischen Darmentzündung. Bei genetisch vorbelasteten Kindern und Erwachsenen löst die Einnahme von glutenhaltigen Lebensmitteln eine Immunreaktion im Dünndarm aus. Das wiederum bewirkt eine Abflachung der Darmzotten und eine schlechtere Aufnahme der Nährstoffe aus der Nahrung, was zu Nahrungsmangelerscheinungen und damit verbundenen Langzeitkomplikationen wie etwa Osteoporose führen kann. Es wird angenommen, dass 1 % der Allgemeinbevölkerung in der westlichen Welt unter Zöliakie leidet.
Im Vergleich dazu wurde die Glutensensitivität in einer 2009 erschienenen klinischen Studie als „eine oder mehrere einer Reihe von immunologischen, morphologischen oder symptomatischen Manifestationen“ beschrieben, die auch bei Zöliakie und dem Reizdarmsyndrom (RDS) auftreten können.[10] In Fällen, in denen eine Reaktion auf Gluten auftritt, Zöliakie und eine Weizenallergie jedoch ausgeschlossen wurden, kann eine Glutensensitivität in Betracht gezogen werden. Obwohl das allgemeine klinische Bild einer Glutensensitivität insbesondere Ähnlichkeiten mit der Zöliakie aufweist, ist diese zumeist weniger stark ausgeprägt, und es sind weder Anti-Gewebstransglutaminase-Antikörper noch Komorbiditäten einer Autoimmunerkrankung nachzuweisen. Es ist anzunehmen, dass rund 40–50 % der Glutensensitivitätspatienten IgG- oder IgA-Antigliadin-Antikörper (AGA) haben.[11][12] Einer Studie zufolge weisen rund 50 % der Glutensensitivitätspatienten, wenige mehr als die Allgemeinbevölkerung, entweder HLA-DQ 2 oder 8 auf.[13] Bei genauerer Untersuchung zeigte sich auch, dass glutensensitive Patienten keine vollständigen histologischen Läsionen entwickeln; ihre Läsionen sind, sofern überhaupt vorhanden, auf die Typen 0–I laut Marsh-Klassifizierung beschränkt. Zudem stellte sich heraus, dass sie eine normale Darmdurchlässigkeit und eine erhöhte Expression von Toll Like-Rezeptoren 2 (TLR2), aber keine Veränderung der Zytokine aufweisen, die an den adaptiven Immunreaktionen TH1 und TH17 wie etwa IL-6, IL-17 A und IL 21 beteiligt sind, die nur bei Patienten mit Zöliakie erhöht sind. Das bisherige Wissen um die Reaktion bei Glutensensitivität legt nahe, dass nur das angeborene Immunsystem involviert ist, wohingegen es sich bei der Zöliakie um eine adaptive Immunreaktion (Autoimmunität) handelt.
Glutensensitivität sollte eine definierte Ursache haben, und obschon diese nicht immer bei der ersten Untersuchung zu Tage tritt, sollten die Betroffenen schließlich entweder in die Kategorie Zöliakie oder Weizenallergie fallen. Nur in seltenen Fällen sollte die Glutensensitivität idiopathisch bleiben. Die idiopathische Glutensensitivität (IGS) tritt spontan oder aus nicht geklärter oder unbekannter Ursache auf und kann mit neuropathischen, myopathischen, dermalen oder intestinalen Anomalien einhergehen. Antigliadin-Antikörper stellen die primäre Verbindung zwischen Gluten und idiopathischer Sensitivität in jenen Fällen dar, „in denen keine eindeutige Beteiligung von Enteropathie oder Allergie vorliegt“.[14] Diese Form der Glutensensitivität ist derzeit umstritten, doch es gibt immer mehr Untersuchungen, die belegen, dass sich die Glutensensitivität von der Zöliakie und Weizenallergie unterscheidet.
Ätiologie[Bearbeiten]
Eine Glutensensitivität kann sich zu jedem Zeitpunkt des Lebens entwickeln, und die symptomatische Erkrankung kann Jahre nach der Entwicklung der Erkrankung auftreten. Entwickelt sich eine Enteropathie bereits in der frühen Kindheit, zeigt sich die symptomatische Erkrankung schneller. Eine Umfrage unter Geriatriepatienten mit Zöliakie in Finnland ergab, dass die Erkrankung in dieser Gruppe wesentlich öfter auftrat als in der Allgemeinbevölkerung.[15] Eine allergische Erkrankung kann mit dem Alter besser oder schlechter werden; es gibt jedoch gewisse Hinweise darauf, dass die erhöhte oder tägliche Anwendung nicht-steroider entzündungshemmender Faktoren (Aspirin, Ibuprofen) einen erhöhten Risikofaktor für Urtikaria oder Anaphylaxie bedeutet, und die Sensibilisierungsdosis kann eine gering dosierte Aspirintherapie wie bei der Behandlung von Herzerkrankungen beinhalten. Eine idiopathische Erkrankung tritt zumeist sehr spät auf. Eine glutensensitive Enteropathie entwickelt sich infolge genetischer und umweltbedingter Faktoren. Abgesehen von bestimmten HLA-DQ-Isoformen (Antigen präsentierende Proteine bei Menschen) und bestimmten Weizenproteinen gibt es keinen klaren Hinweis auf die Beteiligung anderer Gene oder Umweltfaktoren. Ausgeprägte genetische Faktoren wie bei einer glutensensitiven Enteropathie wurden bei der Glutenallergie nicht beobachtet, und bei der idiopathischen Glutensensitivität liegt nur eine schwache HLA-DQ-Verbindung vor. In Untersuchungen wurden bei Patienten ohne Zöliakie, aber mit Gliadin-Antikörpern eine extreme Müdigkeit und Schmerzen beobachtet. Dies wurde als „nicht zöliakische Glutenunverträglichkeit“ bezeichnet, bei der es keine Erklärung hinsichtlich der beteiligten Mechanismen gibt.[16]
Ursachen für die Glutensensitivität[Bearbeiten]
Zugrunde liegende Faktoren[Bearbeiten]
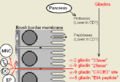
Abbildung der Bürstensaummembran der Dünndarmzotten
Der Darm im Normalzustand[Bearbeiten]
Weizenproteine interagieren mit dem Immunsystem über den DQ2-vermittelten programmierten Zelltod (Apoptose) des Darms sensitiver Menschen. Neue Untersuchungen besagen, dass der zöliakiegeschädigte Darm bei fehlenden HLA-genetischen Faktoren eine Prädisposition für eine Sensitivität aufweist.
So kommen die Proteine aus den Nahrungsmitteln ins Blut[Bearbeiten]
Bei einem normalen Darm werden die Proteine mittels Pepsin (vom Magen freigesetzt), Trypsin und Chymotrypsin (in der Bauchspeicheldrüse produziert und im Darm aktiviert) in Peptide gespaltet. Die Peptide werden weiter verdaut, sobald sie zu den Zotten gelangen, wo Bürstensaumpeptidase die Proteine in Aminosäuren zerlegt. In einem Großteil des Dünndarms können nur kleine gelöste Substanzen wie Wasser die Tight Junctions passieren, doch einige Bereiche der Darmpeptide haben eine Größe von 500 Dalton (4 Aminosäurenreste können diese der Länge nach passieren).
Der glutensensitive Darm[Bearbeiten]
Es gibt immer mehr Hinweise darauf, dass sich der glutensensitive Dünndarm vom normalen Darm unterscheidet. Mehrere Glutenpeptide können die Region hinter den Zellen infiltrieren, die den Dünndarm auskleiden. Das „33-mer“ eines α-2-Gliadins ist wesentlich größer als die maximal zulässige Größe für die Barrieren rund um die Zelle, die Tight Junctions. Omega-5-Gliadinpeptide wurden im Blut von Menschen mit einer bewegungsinduzierten Anaphylaxie nachgewiesen, unterstützt von Salicylaten. Das angeborene „25-mer“ kann mononukleare Zellen im zöliakiegeschädigten Darm erreichen, wird im normalen Darm aber von den Bürstensaumpeptidasen gespaltet. Vielleicht erklärt eine geringere Peptidaseaktivität das Vorliegen dieser Peptide hinter der Bürstensaummembran. Kürzlich wurde festgestellt, dass ein α-9-Gliadinpeptid den „CXCR3“-Rezeptor binden kann, wodurch die Zonulinproduktion verstärkt wird und die Tight Junctions geschwächt werden. Das kann erklären, wie größere Peptide generell in den glutensensitiven Darm gelangen können.
Triticeae und mögliche Rolle selektiver Evolution bei Glutensensitivität[Bearbeiten]
Die Fruchtkörper von Pflanzen enthalten Gene sowie Nährstoffreserven, dank derer die Sämlinge wachsen können. Die Anreicherung mit Nährstoffen lockt Pflanzen- und Allesfresser an. Bei einjährigen Gräsern, die jedes Jahr während einer kurzen Periode Samen freisetzen, müssen die Samen während der Reifung vor Insekten und Tieren geschützt werden, die die Samen für die ganzjährige Verwendung horten möchten. Bei Weizen sind Alpha-Gliadine die Samen speichernden Proteine, aber sie fungieren auch als Inhibitoren für die Alpha-Amylase-Aktivität mancher Tiere, insbesondere aber bei Insekten.[17] Es ist außerdem bekannt, dass Weizen-Gliadine Darmerkrankungen verursachen, wenn sehr junge Nagetiere damit gefüttert werden.[18] Eine kürzlich erschienene Publikation stellt sogar die Frage, ob Weizen überhaupt für irgendjemanden gesund ist.[19] Die Pathologie in Insekten oder künstlich gefütterten Nagetieren liefert leider keinen Hinweis darauf, was die Erkrankung beim Menschen verursacht, doch es ist interessant, dass eine toxikologische Wirkung von Weizen entdeckt wurde, die eine Pathologie beim Menschen auslösen kann. Aus diesen Studien ergibt sich die Konsequenz, dass eine allgemeine Glutensensitivität möglicherweise unterschiedlichen pathologischen Manifestationen, wie etwa Zöliakie, Urtikaria und idiopathischer Sensitivität, zugrunde liegt.
Der Anstieg der Glutensensitivität (insbesondere bei Erwachsenen) kann das Zusammentreffen mehrerer Phänomene widerspiegeln. Eine immer ältere Bevölkerung, genetische Risiken in Verbindung mit einer Verwestlichung, übermäßige Nahrungsaufnahme, sensitivierende Chemikalien, (z. B. nichtsteroidale Antirheumatika) die allergiesteigernde chemische Behandlung von Lebensmitteln (z. B. die enzymatische Desamidierung von Gluten)sowie die modernen Hybrid-Getreidesorten selbst mit einer für den Menschen unverträglichen Glutenzusammensetzung können gemeinsam mit natürlichen Abwehrstoffen in Lebensmitteln dazu beitragen, dass die Grenze zwischen Normalität und Pathologie überschritten wird.
Glutentoxizität[Bearbeiten]
Eine steigende Anzahl von Gliadin-Studien deutet darauf hin, dass Gluten eine direkte und modifizierende Wirkung auf die Zellen des Dünndarms hat. Zwei unterschiedliche Forschungsreihen ergaben, dass unterschiedliche Gliadine die Permeabilität der Epithelzellen (die äußersten Zellen der Zotten) erhöhen und so den Eintritt von Lebensmittelproteinen ermöglichen können. Eine Untersuchung befasste sich mit der Wirkung von ω-5-Gliadin, der Hauptursache der weizenabhängigen bewegungs-/aspirininduzierten Anaphylaxie, und stellte eine erhöhte Permeabilität der Darmzellen infolge dieses Gliadins und eines anderen Weizenalbumins fest.[20] Eine weitere Forschungsreihe zeigte, dass Gliadin einen Chemoattraktans-Rezeptor bindet und einen Faktor erhöht, der Tight Junctions zerstört.[21] Diese Junctions verhindern ein Ausströmen rund um die Zellen, die den Dünndarm auskleiden, wodurch Lebensmittelproteine in den Körper gelangen können.[22] Diese Toxizität von Gluten, die nicht Teil der adaptiven Immunreaktion ist, kann die Verbindung zwischen Weizen- und Glutensensitivität und möglicherweise Diabetes Typ 1 darstellen.
Immunchemie von Gluten[Bearbeiten]
Triticeae-Glutene sind bei mehreren entzündlichen Erkrankungen wichtige Einflussfaktoren. Die Immunchemie lässt sich in angeborene Reaktionen (direkte Stimulation des Immunsystems), Klasse-II-vermittelte Präsentation (HLA DQ), Klasse-I-vermittelte Stimulation von Killerzellen und Antikörper-Erkennung einteilen. Die Reaktion auf Glutenproteine und Polypetid-Regionen unterscheidet sich abhängig von der Art der Glutensensitivität. Die Reaktion hängt auch von der genetischen Zusammensetzung der humanen Leukozytenantigen-Gene ab. Bei einer Enteropathie gibt es mindestens drei Arten der Erkennung: angeborene Immunität (eine Form der zellulären Immunitätsprägung), HLA-DQ und die Antikörper-Erkennung von Gliadin und Transglutaminase.[23] Die drei dominanten Sequenzen, die für die Antikörperreaktion verantwortlich sind, konnten identifiziert werden.[24][25] Bei einer idiopathischen Erkrankung wurde nur die Antikörpererkennung für Gliadin gelöst. Bei der Weizenallergie scheint es angeborene Komponenten zu geben, und die Reaktionswege werden durch IgE gegen Gliadin und andere Weizenproteine vermittelt.[26][27][28]
Unterscheiden verschiedener Formen von Glutensensitivität[Bearbeiten]
Die Glutensensitivität ist nur in seltenen Fällen ohne Ursache. Im Allgemeinen lässt sich bei der Sensitivität zwischen Zöliakie, Glutensensitivität und Weizenallergie unterscheiden. Da Menschen, die unter Zöliakie leiden, auch eine Weizenallergie haben können, schließt die Feststellung der Weizenallergie die Möglichkeit einer Enteropathie nicht aus. Personen, bei denen der Verdacht auf Zöliakie nahe liegt, können auf Anti-Transglutaminase-Antikörper getestet werden, gefolgt von einer Zwölffingerdarmbiopsie, wodurch sich der Verdacht einer aktiven Zöliakie erhärten oder widerlegen lässt.[29] Die Studie, die dies empfiehlt, weist jedoch eine Reihe ATA-positiver/biopsienegativer Personen auf, was auf eine ungleichmäßige Zottenatrophie oder subklinische Pathologie zurückzuführen sein könnte.[30][31] Eine aktuelle Studie empfahl einen distalen Verlauf der Biopsieproben vom Zwölffingerdarm, um die Gefahr falsch- negativer Biopsien auszuschließen. Eine Zöliakie kann generell durch die zusätzliche Durchführung einer HLA-DQ-Typisierung ausgeschlossen werden, bei der DQ2 und DQ8 bei einer Enteropathie bei 98 % der kaukasischen Bevölkerung festgestellt werden, DQ7.5 bei den verbleibenden 1,6 % und weitere 0,4 % keine der drei Typen aufweisen. Ohne Vorliegen von ATA oder HLA-DQ2/8 ist eine Zöliakie als Ursache der Sensitivität mit hoher Wahrscheinlichkeit auszuschließen. In beiden Fällen stehen andere Diagnosemöglichkeiten wie Allergietests zur Verfügung.[32] In seltenen Fällen kann die Glutensensitivität idiopathisch sein, und es besteht die Möglichkeit, dass Weizenproteine eine Rolle bei anderen Erkrankungen spielen; in diesen Fällen kann DQ1 mit der Sensitivität in Verbindung stehen. Untersuchungen haben gezeigt, dass bei bestimmten Patienten mit einer Gluten-Ataxie eine frühzeitige Diagnose und eine Behandlung mit einer glutenfreien Diät die Ataxie verbessern und ein Fortschreiten der Erkrankung verhindern können.[33]
Glutensensitive Enteropathie (GSE)[Bearbeiten]
Zöliakie als klassisch definierte Glutensensitivität und Dermatitis herpetiformis wurden mit einer breiteren Definition von Glutensensitivität in Verbindung gebracht. Der diagnostische „goldene Standard“ der Zöliakie ist die im Rahmen einer Zwölffingerdarmbiopsie nachgewiesene Zottenatrophie. Es ist jedoch heute allgemein anerkannt, dass eine Entzündung des Epithelgewebes des Dünndarms einer Atrophie vorausgeht. In einem frühen Stadium der Erkrankung löst Gluten die T-Lymphozytenerkennung von Glutenhydrolysaten (Polypeptide von Gluten) aus, und Glutenpeptide docken an Transglutaminase aus Säugetiergewebe (tTG) an. Diese zweite Interaktion bewirkt die Produktion von „Eigen“-Antikörpern auf tTG. Das erhöht die Lymphozyten im Epithel des Dünndarms (Marsh I und II) und Antikörper-tTG-Komplexe, die als Ablagerungen gelten. Daraus entwickelt sich normalerweise eine Zöliakie (Marsh III und IV). Die ernährungsbedingte Ursache einer glutensensitiven Enteropathie beschränkt sich nicht nur auf Weizengluten; 'Glutene' aus allen bekannten genießbaren Kultursorten von Triticeae können bei empfindlichen Personen eine glutensensitive Enteropathie auslösen.
Es gibt eine Vielzahl von Krankheitsbildern, die auf eine glutensensitive Enteropathie zurückzuführen sind und vor der Entwicklung der Zöliakie auftreten und glutenreaktiv sein können. Obwohl das Ausmaß der Zottenatrophie in manchen Fällen von glutensensitiver Enteropathie nicht für die Feststellung einer klinischen Zöliakie ausreicht, kann die erhöhte zelluläre Immunität Erkrankungen hervorrufen, die häufiger bei Zöliakie festgestellt werden. Erkrankungen infolge einer glutensensitiven Enteropathie sind wichtige Diagnosekriterien für die Glutensensitivität, wenn keine offensichtliche Anomalie des Darms vorliegt.
| DQ-Haplotypen – Zöliakie | |||||
|---|---|---|---|---|---|
| DQ-Hap. | 2.5 | 2.2 | 7.5 | 8.0 | Sonstige |
| 2.5 | 34 | 22 | 4.0 | 2.0 | 22 |
| 2.2 | 1.1 | 4.0 | 1.1 | 2.9 | |
| 7.5 | 0.3 | 0.0 | 1.3 | ||
| 8.1 | 2.9 | 2.0 | |||
| Sonstige | 0.4 | ||||
| DQ-Haplotypen – Normalbevölkerung | |||||
| DQ-Hap. | 2.5 | 2.2 | 7.5 | 8.1 | Sonstige |
| 2.5 | 1.7 | 2.9 | 2.9 | 1.8 | 15.1 |
| 2.2 | 1.2 | 2.4 | 1.6 | 12.8 | |
| 7.5 | 1.2 | 1.5 | 1.3 | ||
| 8.1 | 0.5 | 8.0 | |||
| Sonstige | 33.4 | ||||
| Chancenverhältnis | |||||
| DQ-Hap. | 2.5 | 2.2 | 7.5 | 8.1 | Sonstige |
| 2.5 | 20:11 | 8:12 | 1.4:16 | 1.1:1 | 1.5:15 |
| 2.2 | 1:1.1 | 1.6:14 | 1:1.3 | 1:5 | |
| 7.5 | 1:4 | 0 | 1:10 | ||
| 8.1 | 6:13 | 1:4 | |||
| Sonstige | 1:100 | ||||
Die Präsentation einer glutensensitiven Enteropathie ist häufig die Folge der Ersterkennung der sekundären Erkrankung, bei deren Folgeuntersuchungen (ATA-Test, AGA-Test, HLA-DQ-Typisierung und/oder Biopsie) die primäre Erkrankung festgestellt wird. Die sekundäre Erkrankung in Verbindung mit der glutensensitiven Enteropathie scheint eine spät beginnende Zöliakie zu einem systemischen Phänomen zu machen.
Idiopathische Glutensensitivität[Bearbeiten]
Idiopathische Erkrankungen werden als erweiterte Form der Glutensensitivität vorgeschlagen. Definitionsgemäß ist die Ursache bei einer idiopathischen Erkrankung nicht klar. Vor 100 Jahren, bevor Gluten noch als Ursache der Zöliakie entdeckt wurde, bezeichnete man die Zöliakie bei Erwachsenen unter anderem als adulte idiopathische Steatorrhoe, nicht tropische Sprue oder sprue nostras. Die Diskussion über diese Untergruppe resultiert aus der Tatsache, dass die Identifizierung aller Grade von GSE und Allergien nicht einheitlich erfolgt. Die meisten Fälle einer frühen GSE blieben – insbesondere vor 2005 – unerkannt. Es scheint einen geringen Anteil nicht-GSE-glutensensitiver Menschen zu geben, die keine Glutenallergien haben, aber dennoch einen erhöhten Anti-Gliadin-IgA oder -IgG aufweisen. Häufige Symptome sind periphere Neuropathien und zerebelläre Ataxien. Innerhalb der glutensensitiven Enteropathie kann dies durch eine Verkalkung der Kanäle des Gehirns und eine Avitaminose erklärt werden. Angesichts der Tatsache, dass diese Kohorte von Glutensensitivität idiopathisch ist, bleibt auch die Rolle von Allergien, sonstigen Sensitivitäten (z. B. Aspirin) oder anderen Faktoren in der idiopathischen Glutensensitivität ungelöst. Silente Erkrankung. Je nach Test haben zwischen 3 und 15 % der Normalbevölkerung Anti-Gliadin-Antikörper (AGA). Studien mit Anti-Gliadin-Antikörpern (AGA) zeigen dies bei nicht diagnostizierten oder unbehandelten Personen mit AGA, wobei ein erhöhtes Risiko von Lymphomen und ein verringertes Risiko anderer Wohlstandserkrankungen vorliegen.[34] Es ist nicht bekannt, wie viele davon ein frühes Stadium von GSE aufweisen.
Sonstige Erkrankungen[Bearbeiten]
Die Antikörper gegen α-Gliadin waren bei nicht-zöliakischen Personen mit Oralulzeration wesentlich erhöht.[35] Anti-α-Gliadin-Antikörper sind bei Zöliakie häufig, weniger häufig bei subklinischer Zöliakie, finden sich aber auch in einer Untergruppe, die diese Erkrankung nicht aufweist. Die Referenz aus dem Jahr 1991 stammt aus einer Zeit, als es noch keine Untersuchungen auf eine subklinische Zöliakie gab. Von den Personen mit Pseudoexfoliationssyndrom wiesen 25 % einen erhöhten Anti-Gliadin-IgA-Wert auf.[36] Ein Viertel der Menschen mit Sjögren-Syndrom reagierten auf Gluten, von fünf Personen mit einer positiven Reaktion auf Gluten wurde nur bei einer Person Zöliakie und bei einer weiteren Person eine mögliche glutensensitive Enteropathie nachgewiesen; die anderen drei Personen schienen glutensensitiv zu sein. Alle waren HLA-DQ2- und/oder DQ8-positiv. Ebenso wurde bei Patienten mit einer speziellen Form des Reizdarmsyndroms mithilfe einer glutenfreien Diät Verbesserungen erzielt.[37][38]
Die Behandlung zur Rückbildung der Symptome von Morbus Crohn bei einer Eliminationsdiät ergab, dass die wichtigsten Symptome auslösenden Lebensmittel Weizen und Milchprodukte waren.[39] Eine spätere Untersuchung zeigte eine geringe IgE-vermittelte Reaktion außer auf Milchprodukte,[40] während eine weitere Untersuchung keine signifikante IgE-Verbindung zu Lebensmitteln ergab.[41] Morbus Crohn kann mit Weizen in Verbindung stehen, aber unabhängig vom Gluten sein. Morbus Crohn scheint mit einer hohen Anzahl von Anti-Hefe-Antikörpern (ASCA) in Verbindung zu stehen (Hefe-Antigene sind in Brot und anderen getreidebasierten Produkten zu finden), und die Betroffenen haben keine Lektin bindenden Proteine, so dass die Mannose tragenden Antigene aus Hefe, die Antikörper, die diese binden und die entzündliche Colitis verschlimmern. Ein Problem bei den oben genannten Untersuchungen ist die große Häufigkeit von Markern für eine glutensensitive Enteropathie, so dass man hinterfragen muss, wie idiopathisch diese Erkrankungen sind, wenn keine genaue Untersuchung auf eine glutensensitive Enteropathie erfolgt ist.
Glutenallergiebedingte Sensitivitäten[Bearbeiten]
In den letzten 10 Jahren hat sich gezeigt, dass Allergien auf bestimmte Substanzen nicht vorhersehbar reagieren. Eindeutige Beispiele dafür sind anstrengungsinduzierte Anaphylaxie und anstrengungsinduziertes Asthma; bei der weizenabhängigen anstrengungsinduzierten Anaphylaxie (WDEIA) geht man heute davon aus, dass diese durch die Aufnahme von Gluten hervorgerufen wird, das irgendwie in das Blut gelangt. Dies hält man heute für die Ursache mancher Formen von Ekzemen. Kürzlich durchgeführte Studien zu zwei Weizenallergenen haben gezeigt, dass diese in der Lage sind, die Barriere zwischen Darm und Blutbahn zu passieren. Am aktivsten ist dabei ω-5-Gliadin, eine Glutenkomponente, die ein starkes Allergen darstellt und die weizenabhängige anstrengungsinduzierte Anaphylaxie (WDEIA) verursacht. Allergietests ergeben möglicherweise keine Glutenallergien, da die unfraktionierten Allergene diesen Tests verborgen bleiben und die meisten derzeit verfügbaren Tests diese neuen Allergene nicht erkennen. Zudem weisen Allergien normalerweise IgE auf, doch einige Untersuchungen deuten darauf hin, dass es mehrere Klassen von Reaktionen gibt, die mit IgE in Verbindung stehen, wie etwa IgG1, IgG2 oder IgG4.[42] Eine Glutenallergie kann die Ursache mancher idiopathischer Glutensensitivitäten sein, und eine Glutenallergie kann eine sekundäre Folge einer glutensensitiven Enteropathie sein.
Vergleichende Pathophysiologie[Bearbeiten]
| Glutensensitive Enteropathie | Weizenallergie | Glutensensitive idiopathische Neuropathie | |
|---|---|---|---|
| Typische Symptome | Steatorrhoe, Fehlernährung, Durchfall, Laktoseintoleranz, Nahrungsmittelallergien | Ekzeme, Asthma | Ataxie, periphere Neuropathien |
| Primäre Gewebeziele | Epithel des Dünndarms | (Epi)Dermis, Bronchien, Darm | Zentralnervensystem, Peripherienervensystem |
| Atypische Pathologien | Sonstige Autoimmunerkrankungen, chronische Verstopfung, Neuropathien, Krebs (Lymphom) | Arthritis, Migräne, Anaphylaxie (anstrengungs- oder aspirininduziert) | nicht bekannt |
| Sekundäre Ziele (häufig) Blut (Chemie), Darm, Nervensystem, Autoantigene | Bindegewebe, Zentralnervensystem, Gefäße | ||
| Immunoglobin-Isotyp | IgA, IgG | IgE, IgG, IgA | IgG, IgA |
| Antikörpererkennung | α/β,γ-Gliadin (AGA), Transglutaminase (ATA) | Albumine, Globuline, Prolamine (ω-Gliadin)(AGA), Gluteline (LMW)(AGA) | α/β-Gliadin |
| HLA-Verbindungen | DQ2.5, DQ8, DQ2.2/DQ7.5 | nicht bekannt | DQ8?, DQ1? |
| Zelluläre Immunität | T-Zellen, Eosinophile, Monozyten | Mastzellen, Eosinophile | nicht bekannt |
| Angeborene Antworten | (α-Gliadin) immun, erhöhte Permeabilität | (ω-5-Gliadin) – erhöhte Permeabilität | nicht bekannt |
| Hintergrund & Referenzen | Zöliakie, GSE-Erkrankungen | Weizenallergie | IGS-Neuropathien |
Hinweise zur Tabelle: Merkmale der idiopathischen Neuropathie lassen annehmen, dass alle GSE-Kohorten entfernt wurden, sofern es ein glutensensitives, aber kein GSE-Kontingent gibt. Anti-Gliadin-Antikörper umfassen alle Immunoglobulin-Isotypen und alle Gliadin-Isoformen. Siehe auch oben den Abschnitt zur Immunchemie von Gluten.
Glutenquellen[Bearbeiten]
Aus der Sicht der Glutensensitivität gibt es nicht eine einzige Definition von Gluten, die exakt alle möglichen pathogenen Glutene beschreibt. Bei Weizenallergien kann es ein breites Spektrum von Sorten geben, die Allergien mit ähnlichen Proteinen auslösen können, die omega-Gliadin-Proteine weisen häufig ähnliche Proteine wie Hafer auf, aber eine omega-Gliadin-Allergie ist kein Hinweis auf eine Haferallergie oder -intoleranz.[43] Ein Mensch kann auf Weizen allergisch sein, nicht aber auf Roggen.[44]
Gluteline wurden nicht über eine breite Taxa hinweg charakterisiert. Bei einer idiopathischen Glutensensitivität sind die Antikörper, die mit der Erkrankung einhergehen, Anti-Gliadin-Antikörper. Ob diese Antikörper pathogen oder einfach nur Hinweise auf zirkulierendes Gliadin sind, ist nicht bekannt. Bei der glutensensitiven Enteropathie verursachen Gliadin und homologe Proteine aus Roggen und Gerste eine Erkrankung. Mit einer Erkrankung verbundene T-Zellen-Epitope wurden in klebrigen Proteingenen in allen Arten gefunden, die innerhalb des Triticeae-Stamms sequenziert sind.[45]
Da Gerste entfernt mit Weizen verwandt ist, aber pathogene Epitope aufweist, kann man davon ausgehen, dass alle Mitglieder des Triticeae-Stamms T-Zellen-Standorte führen sollten, die einer Erkrankung standhalten (siehe auch Genetik der Triticeae). Obwohl dies in manchen Standardwerken nicht explizit erwähnt wird, finden sich die pathogenen Glutene des Weizens auch in Dinkel und Kamut (beides Weizenformen) sowie Triticale (eine artenübergreifende Triticeae-Kreuzung).
Die Kontroverse rund um den Hafer[Bearbeiten]

Hafer gehört zur Familie der Aveneae-Gräser, die zur Unterfamilie Pooideae gehört – ebenso wie Triticeae (zu der Weizen, Roggen, Gerste und viele andere Sorten zählen). Hafer ist das Getreide, das am engsten mit dem Triticeae-Getreide verwandt ist. Manche, wenn auch nicht alle Kultursorten des Hafers enthalten die pathogenen Proteine, die eine Reaktion bei glutensensitiven Menschen und jenen mit Zöliakie hervorrufen.[46] Die Hafersamen sind ähnlich den Samen von Weizen, Gerste und Roggen; eine Kreuz-Kontamination zwischen diesen Körnern ist schwer zu beseitigen.
Ursprung der Kontroverse[Bearbeiten]
Nach dem Zweiten Weltkrieg hielt man Weizen für die Ursache von Zöliakie, und das Gluten des Weizens wurde bald darauf als Ursache identifiziert. Damals gab es noch keine Zwölffingerdarmbiopsie, den heutigen „Goldstandard“ in der Diagnose,[47] so dass die Erkrankung indirekt gemessen wurde. In zwei Untersuchungen erhielten drei Kinder täglich 75 bis 150 Gramm Hafer und entwickelten Symptome. In drei gleichzeitig durchgeführten Untersuchungen durften zehn Kinder und zwei Erwachsene 28 bis 60 Gramm Hafer essen und entwickelten keine Symptome.[48] Da Weizen, Gerste und manchmal auch Roggen häufig den Hafer kontaminieren,[49][50] galt Hafer bis zum Zeitpunkt dieser Entdeckung als Gift für Zöliakie-Patienten.
Neueste Erkenntnisse[Bearbeiten]
Zwar ist das Problem der Kontamination seit mehreren Jahren bekannt, doch das Wissen über den Zusammenhang von Hafer und Gluten nimmt stetig zu. Eine im Februar 2011 veröffentlichte Untersuchung entdeckte ein unterschiedliches Maß an Toxizität bei unterschiedlichen Sorten von Hafer. Das deutet darauf hin, dass eine Kreuz-Kontamination nicht der einzige Grund ist, weshalb manche Hafersorten bei manchen Personen mit einer Glutenintoleranz eine Reaktion auslösen.[46] Eine im Juni 2008 veröffentlichte Untersuchung ergab, dass von 109 untersuchten Haferquellen 85 ein nicht akzeptables Maß an Gluten von Weizen, Gerste oder Roggen aufwiesen.[51] Der Triticeae-kontaminierte Hafer in der Untersuchung kam aus vielen Ländern, was darauf hinweist, dass bei einer Glutensensitivität die meisten Haferquellen wegen der Kontamination nicht geeignet sind.
Tolerierbare Mengen an Gluten[Bearbeiten]
Zusammenfassend kann man ausgehend von den jüngsten Entwicklungen sagen, dass Hafer in einer glutenfreien Diät toleriert werden kann, die Kontamination durch Triticeae-basiertes Gluten in Haferprodukten hingegen auf 20 ppm (20 mg pro kg) beschränkt werden sollte. Die US-amerikanischen Bundesstaaten können sich bei Haferprodukten gegebenenfalls über den Standard zur Kennzeichnung glutenfreier Produkte hinwegsetzen (siehe Politik in Hinblick auf glutenfreie Produkte und Hafer).[52]
Prüfung auf Glutenfreiheit[Bearbeiten]
Ab Februar 2011 ist G12, der neueste verfügbare monoklonale Antikörper, der einzige, der nachweislich eine Kreuz-Kontamination in Hafer und das inhärente Gluten / Avenin feststellt, das ebenfalls in manchen Hafersorten vorhanden ist.[46] Andere Erkennungsmethoden werden zwar derzeit von vielen Organisationen zur Zertifizierung glutenfreier Produkte akzeptiert, können jedoch diese zweite Form von Gluten im Hafer nicht feststellen. Das mag eine Erklärung dafür sein, warum manche Zöliakie-Patienten auf Hafer reagieren und andere nicht. Ein gerstensensitiver ELISA mit dem Namen R5-Sandwich-Assay erkennt Gluten in 25 reinen Hafersorten nicht, kann jedoch Gerste, Weizen und Roggen feststellen.[51] Erkrankungssensitive Anbaumethoden, Antikörpertests und sortenspezifische genetische Tests können reinen Hafer hervorbringen.[51] In den USA sind drei heimische glutenfreie Marken sowie eine aus Irland importierte Marke erhältlich, die „glaubt“, 99,95 % reinen Hafer darzustellen.[53][54] Zwei Marken in den USA verwenden den R5-Antikörpertest und behaupten, weniger als 20 ppm definiertes Gluten aufzuweisen.[55] Der R5-Antikörpertest ist jedoch nachweislich nicht so empfindlich wie der G12-Test.
Glutenfreie Ernährung und Hafer – die Politik[Bearbeiten]
Aktuelle Richtlinien[Bearbeiten]
Folglich besagt der aktuelle internationale Standard für die Bezeichnung „Glutenfrei“, der 1981 entworfen und 1983[56] im Rahmen des Codex Alimentarius (Kalifornien), unterzeichnet wurde:
For the purpose of this standard, gluten is defined as those proteins, commonly found in wheat, triticale, rye, barley or oats to which some persons are intolerant.[57]
Der Standpunkt der American Dietetic Association in ihrem Nutrition Care Manual zur Verwendung von Hafer in einer aus medizinischen Gründen erforderlichen glutenfreien Diät lautet wie folgt:
However, commercially available oats in the United States may be contaminated with small amounts of wheat, barley, or rye. For this reason, if you are newly diagnosed with celiac disease, you should not eat oats. Once your intestine heals, you may want to discuss the use of oats with your dietitian and physician.[49]
indicating the need for a separate standard of purity for people with gluten sensitivity.
Neue Standards, die gerade entwickelt werden[Bearbeiten]
Der Codex Alimentarius wird gerade überarbeitet. Die überarbeitete Version wird bei der Versammlung der Codex Alimentarius Commission Ende Juni 2008 präsentiert.[58] Der neue Vorschlag beschränkt die Menge kontaminierender Substanzen in Produkten, die als glutenfreie Produkte bezeichnet werden dürfen:
Gluten-free foods are dietary foods a) consisting of or made only from one or more ingredients which do not contain wheat (i.e., all Triticum species, such as durum wheat, spelt, and kamut), rye, barley, oats1 or their crossbred varieties, and the gluten level does not exceed 20 mg/kg in total, based on the food as sold or distributed to the consumer, and/or b) consisting of one or more ingredients from wheat (i.e., all Triticum species, such as durum wheat, spelt, and kamut), rye, barley, oats1 or their crossbred varieties, which have been specially processed to remove gluten, and the gluten level does not exceed 20 mg/kg in total, based on the food as sold or distributed to the consumer.[59]
1 Das Komitee beschloss, dass die zulässige Menge von nicht durch Weizen, Roggen oder Gerste kontaminiertem Hafer in Lebensmitteln, die unter diesen Standard fallen, auf nationaler Ebene festgelegt werden darf.[59]
Die Canadian Celiac Association, die den Nutzen von Vollhafer in einer glutenfreien Ernährung erkannte, bemühte sich darum sicherzustellen, dass Hafer und Haferprodukte die von der Canadian Food Inspection Agency und von Health Canada festgelegten Standards für glutenfreie Produkte erfüllen:
in consultation with Health Canada, Agriculture & Agri-Food Canada and the Canadian Food Inspection Agency, has established requirements for growing, processing, and purity testing and labelling of pure oats.[60]
Diäten[Bearbeiten]
Glutenfreier Hafer in einer glutenfreien Diät. Glutenfreier Hafer kann eine wertvolle Quelle für Ballaststoffe, Vitamin B, Eisen, Zink und komplexe Kohlenhydrate darstellen.[61] Kürzlich durchgeführte Untersuchungen zeigen, dass glutensensitive Menschen, die sich glutenfrei ernähren, häufig zu viel einfache Stärke, zu wenige Ballaststoffe und zu wenig Vitamin B zu sich nehmen. Derzeit enthalten die meisten Richtlinien zu einer glutenfreien Ernährung keinen Hafer. Obwohl sich das voraussichtlich ändern wird, wird Hafer im ersten Jahr nach der Diagnose wegen der Gefahr einer hafersensitiven Enteropathie, dem Wunsch nach Festlegung einer klinischen Basis und der Komplexität der Kontaminationsgefahr nicht empfohlen.[62]
Die Konsumation von Hafer bei Vorliegen von Anti-Gliadin-Antikörpern erhöht die Anti-Avenin-Antikörper und kann eine hafersensitive Enteropathie fördern. Nach Beginn des Haferkonsums kann eine Zwölffingerdarmbiopsie ratsam sein. Der DQ-Phänotyp aller drei bislang untersuchten Personen mit einer hafersensitiven Enteropathie wies darauf hin, dass DQ2-Homozygoten eine Gefahr für eine hafersensitive Enteropathie darstellen. Vorzugsweise sollten sich Menschen, bei denen die Zöliakie gerade erst diagnostiziert wurde, an einen Ernährungsberater wenden. Es gibt jedoch auch Richtlinien für die Einführung von reinem, nicht kontaminierten Hafer in die glutenfreie Diät.[62]
Einzelnachweise[Bearbeiten]
- Hochspringen ↑ C. Catassi u.a.: Non-Celiac Gluten Sensitivity: The New Frontier of Gluten Related Disorders.. In: Nutrients. 5, 2013, S. 3839-3853. doi:10.3390/nu5103839.
- Hochspringen ↑ Jennifer Welsh: Researchers Who Provided Key Evidence For Gluten Sensitivity Have Now Thoroughly Shown That It Doesn't Exist, Business Insider vom 15. Mai 2014, abgerufen am 3. November 2014 (englisch).
- Hochspringen ↑ Biesiekierski JR, Peters SL, Newnham ED, Rosella O, Muir JG, Gibson PR. "No effects of gluten in patients with self-reported non-celiac gluten sensitivity after dietary reduction of fermentable, poorly absorbed, short-chain carbohydrates." Gastroenterology. 2013 Aug;145(2):320-8.e1-3. doi: 10.1053/j.gastro.2013.04.051. Epub 2013 May 4.(Pubmed)
- Hochspringen ↑ Biesiekierski JR, Muir JG, Gibson PR. "Is gluten a cause of gastrointestinal symptoms in people without celiac disease?" Curr Allergy Asthma Rep. 2013 Dec;13(6):631-8. doi: 10.1007/s11882-013-0386-4.
- Hochspringen ↑ A. Sapone u. a.: Differential mucosal IL-17 expression in two gliadin-induced disorders: gluten sensitivity and the autoimmune enteropathy celiac disease. In: International Archives of Allergy and Immunology. 2010;152, S. 75–80.
- Hochspringen ↑ R.P. Ford: The gluten syndrome. A neurological disease. In: Medical Hypotheses. 2009; 73 (3), S. 438–440.
- ↑ Hochspringen nach: 7,0 7,1 F. Dickerson u. a.: Markers of gluten sensitivity and celiac disease in recent onset psychosis and multi-episode schizophrenia. In: Biological Psychiatry. 2010;68(1), S. 100–104.
- ↑ Hochspringen nach: 8,0 8,1 M. Hadjivassiliou u. a.: Myopathy associated with gluten sensitivity. In: Muscle Nerve. 2007;35, S. 443–450.
- Hochspringen ↑ A. Sapone u. a.: Differential mucosal IL-17 expression in two gliadin-induced disorders: gluten sensitivity and the autoimmune enteropathy celiac disease. In: International Archives of Allergy and Immunology. 2010;152, S. 75–80; R.P. Ford: The gluten syndrome. A neurological disease. In: Medical Hypotheses. 2009; 73 (3), S. 438–440.
- Hochspringen ↑ E.F. Verdu, D. Armstrong, J.A. Murray: Between celiac disease and irritable bowel syndrome: The ‘No Man’s Land’ of Gluten Sensitivity. In: American Journal of Gastroenterology. 2009;104(6), S. 1587–1594.
- Hochspringen ↑ A. Sapone u. a.: Differential mucosal IL-17 expression in two gliadin-induced disorders: gluten sensitivity and the autoimmune enteropathy celiac disease. In: International Archives of Allergy & Immunology. 152 (2010), S. 75–80.
- Hochspringen ↑ N. Bizzaro u. a.: Cutting edge issues in celiac disease and in gluten intolerance. In: Clinical Reviews in Allergy & Immunology. 2010.
- Hochspringen ↑ A. Sapone u. a.: Differential mucosal IL-17 expression in two gliadin-induced disorders: gluten sensitivity and the autoimmune enteropathy celiac disease. In: International Archives of Allergy & Immunology. 152 (2010), S. 75–80.
- Hochspringen ↑ M. Hadjivassiliou, R. Grünewald, B. Sharrack u. a.: (2003). Gluten ataxia in perspective: epidemiology, genetic susceptibility and clinical characteristics. In: Brain. 126 (Pt 3)2003, S. 685–691. doi:10.1093/brain/awg050. PMID 12566288.
- Hochspringen ↑ A. Vilpulla, P. Collin, M. Maki u. a. (2008) Undetected coeliac disease in the elderly. A biopsy-proven population-based study. Digestive and Liver Disease 40 (2008) 809-813
- Hochspringen ↑ Biesiekierski, Jessica R u. a.: Gluten Causes Gastrointestinal Symptoms in Subjects Without Celiac Disease: A Double-Blind Randomized Placebo-Controlled Trial. In: Am J Gastroenterol. 106, Nr. 3, März 2011, S. 508–514. doi:10.1038/ajg.2010.487. PMID 21224837.
- Hochspringen ↑ Bandani AR: Effect of plant a-amylase inhibitors on sunn pest, Eurygaster integriceps Puton (Hemiptera: Scutelleridae), alpha-amylase activity. In: Commun. Agric. Appl. Biol. Sci.. 70, Nr. 4, 2005, S. 869–873. PMID 16628930.
- Hochspringen ↑ Stepánková R, Kofronová O, Tucková L, Kozáková H, Cebra JJ, Tlaskalová- Hogenová H: Experimentally induced gluten enteropathy and protective effect of epidermal growth factor in artificially fed neonatal rats. In: J. Pediatr. Gastroenterol. Nutr.. 36, Nr. 1, Januar 2003, S. 96–104. doi:10.1097/00005176-200301000-00018. PMID 12500003.
- Hochspringen ↑ Bernardo D, Garrote JA, Fernández-Salazar L, Riestra S, Arranz E: Is gliadin really safe for non‐coeliac individuals? Production of interleukin 15 in biopsy culture from non‐coeliac individuals challenged with gliadin peptides. In: Gut. 56, Nr. 6, 2007, S. 889–890. doi:10.1136/gut.2006.118265. PMID 17519496. PMC 1954879 (freier Volltext).
- Hochspringen ↑ Bodinier M, Legoux MA, Pineau F, u. a.: Intestinal translocation capabilities of wheat allergens using the Caco-2 cell line. In: J. Agric. Food Chem.. 55, Nr. 11, Mai 2007, S. 4576–4583. doi:10.1021/jf070187e. PMID 17477542.
- Hochspringen ↑ Thomas KE, Sapone A, Fasano A, Vogel SN: Gliadin stimulation of murine macrophage inflammatory gene expression and intestinal permeability are MyD88-dependent: role of the innate immune response in Celiac disease. In: J. Immunol.. 176, Nr. 4, Februar 2006, S. 2512–2521. PMID 16456012.
- Hochspringen ↑ K.M. Lammers, R. Lu, J. Brownley u. a.: Gliadin Induces an Increase in Intestinal Permeability and Zonulin Release by Binding to the Chemokine Receptor CXCR3. In: Gastroenterology. 135, Nr. 1, März 2008, S. 194–204.e3. doi:10.1053/j.gastro.2008.03.023. PMID 18485912. PMC 2653457 (freier Volltext).
- Hochspringen ↑ D.A. van Heel, J. West: Recent advances in coeliac disease. In: Gut. 55, Nr. 7, Juli 2006, S. 1037–1046. doi:10.1136/gut.2005.075119. PMID 16766754. PMC 1856316 (freier Volltext).
- Hochspringen ↑ http://www.livescience.com/health/celiac-disease-gluten-peptides-100721.html
- Hochspringen ↑ J.A. Tye-Din, J.A. Stewart, J.A. Dromey, T. Beissbarth, D.A. van Heel, A. Tatham, K. Henderson, S.I. Mannering, C. Gianfrani, D.P. Jewell, A.V. Hill, J. McCluskey, J. Rossjohn, R.P. Anderson: Comprehensive, quantitative mapping of T cell epitopes in gluten in celiac disease. In: Sci Transl Med. 2, Nr. 41, 2010, S. 41ra51. doi:10.1126/scitranslmed.3001012. PMID 20650871.
- Hochspringen ↑ C. Bittner, B. Grassau, K. Frenzel, X. Baur: Identification of wheat gliadins as an allergen family related to baker's asthma. In: J. Allergy Clin. Immunol.. 121, Nr. 3, März 2008, S. 744–749. doi:10.1016/j.jaci.2007.09.051. PMID 18036646.
- Hochspringen ↑ Matsuo H, Dahlström J, Tanaka A, u. a.: Sensitivity and specificity of recombinant omega-5 gliadin-specific IgE measurement for the diagnosis of wheat-dependent exercise-induced anaphylaxis. In: Allergy. 63, Nr. 2, Februar 2008, S. 233–236. doi:10.1111/j.1398-9995.2007.01504.x. PMID 18186814.
- Hochspringen ↑ M. Akagawa, T. Handoyo, T. Ishii, S. Kumazawa, N. Morita, K. Suyama: Proteomic analysis of wheat flour allergens. In: J. Agric. Food Chem.. 55, Nr. 17, August 2007, S. 6863–6870. doi:10.1021/jf070843a. PMID 17655322.
- Hochspringen ↑ A.D. Hopper, S.S. Cross, D.P. Hurlstone u. a.: Pre-endoscopy serological testing for celiac disease: evaluation of a clinical decision tool. In: BMJ. 334, Nr. 7596, April 2007, S. 729. doi:10.1136/bmj.39133.668681.BE. PMID 17383983. PMC 1847864 (freier Volltext).
- Hochspringen ↑ A.D. Hopper, S.S. Cross, D.S. Sanders: Patchy villous atrophy in adult patients with suspected gluten-sensitive enteropathy: is a multiple duodenal biopsy strategy appropriate?. In: Endoscopy. 40, Nr. 3, März 2008, S. 219–224. doi:10.1055/s-2007-995361. PMID 18058655.
- Hochspringen ↑ K. Kaukinen, M. Peräaho, P. Collin u. a.: Small-bowel mucosal transglutaminase 2-specific IgA deposits in celiac disease without villous atrophy: a prospective and randomized clinical study. In: Scand. J. Gastroenterol.. 40, Nr. 5, Mai 2005, S. 564–572. doi:10.1080/00365520510023422. PMID 16036509.
- Hochspringen ↑ K. Kaukinen, K. Turjanmaa, M. Mäki u. a.: Intolerance to cereals is not specific for coeliac disease. In: Scand. J. Gastroenterol.. 35, Nr. 9, September 2000, S. 942–946. doi:10.1080/003655200750022995. PMID 11063153.
- Hochspringen ↑ M. Hadjivassiliou, D.S. Sanders, N. Woodroofe u. a.: Gluten ataxia. In: The Cerebellum. 2008, S. 494–498.
- Hochspringen ↑ L.A. Anderson, S.A. McMillan, R.G. Watson u. a.: Malignancy and mortality in a population-based cohort of patients with coeliac disease or "gluten sensitivity". In: World J. Gastroenterol.. 13, Nr. 1, 2007, S. 146–151. PMID 17206762.
- Hochspringen ↑ C. O'Farrelly, C. O'Mahony, F. Graeme-Cook, C. Feighery, B.E. McCartan, D.G. Weir: Gliadin antibodies identify gluten-sensitive oral ulceration in the absence of villous atrophy. In: J. Oral Pathol. Med.. 20, Nr. 10, 1991, S. 476–478. doi:10.1111/j.1600-0714.1991.tb00407.x. PMID 1753350.
- Hochspringen ↑ Ringvold A, Overgaard RG: Increased IgA antibodies to gluten and gliadin in serum of persons with ocular pseudo-exfoliation. In: Acta ophthalmologica Scandinavica. 73, Nr. 2, 1995, S. 171–172. doi:10.1111/j.1600-0420.1995.tb00662.x. PMID 7656149.
- Hochspringen ↑ M. Lidén, G. Kristjánsson, S. Valtýsdóttir, R. Hällgren: Gluten sensitivity in patients with primary Sjögren's syndrome. In: Scand. J. Gastroenterol.. 42, Nr. 8, 2007, S. 962–967. doi:10.1080/00365520701195345. PMID 17613926.
- Hochspringen ↑ M. I. Vazquez-Roque, M. Camilleri u. a.: A controlled trial of gluten-free diet in patients with irritable bowel syndrome-diarrhea: effects on bowel frequency and intestinal function. In: Gastroenterology. Band 144, Nummer 5, Mai 2013, S. 903–911.e3, ISSN 1528-0012. doi:10.1053/j.gastro.2013.01.049. PMID 23357715. PMC 3633663 (freier Volltext).
- Hochspringen ↑ E.M. Workman, V. Alun Jones, A.J. Wilson, J.O. Hunter: Diet in the management of Crohn's disease. In: Human nutrition. Applied nutrition. 38, Nr. 6, 1984, S. 469–473. PMID 6526690.
- Hochspringen ↑ M. Frieri, M. Claus, M. Boris, M. Zitt, D. Scalise, N. Harris: Preliminary investigation on humoral and cellular immune responses to selected food proteins in patients with Crohn's disease. In: Annals of allergy. 64, Nr. 4, 1990, S. 345–351. PMID 2321808.
- Hochspringen ↑ A. Huber, D. Genser, S. Spitzauer, O. Scheiner, E. Jensen-Jarolim: IgE/anti-IgE immune complexes in sera from patients with Crohn's disease do not contain food-specific IgE. In: Int. Arch. Allergy Immunol.. 115, Nr. 1, 1998, S. 67–72. doi:10.1159/000023832. PMID 9430498.
- Hochspringen ↑ T. Pfeil, U. Schwabl, W.T. Ulmer, W. König: Western blot analysis of water-soluble wheat flour (Triticum vulgaris) allergens. In: Int. Arch. Allergy Appl. Immunol.. 91, Nr. 3, 1990, S. 224–231. doi:10.1159/000235121. PMID 1693911.
- Hochspringen ↑ B.A. Baldo, S. Krilis, C.W. Wrigley: Hypersensitivity to inhaled flour allergens. Comparison between cereals. In: Allergy. 35, Nr. 1, 1980, S. 45–56. doi:10.1111/j.1398-9995.1980.tb01716.x. PMID 6154431.
- Hochspringen ↑ S. Karatay, T. Erdem, A. Kiziltunc u. a.: General or personal diet: the individualized model for diet challenges in patients with rheumatoid arthritis. In: Rheumatol. Int.. 26, Nr. 6, 2006, S. 556–560. doi:10.1007/s00296-005-0018-y. PMID 16025333.
- Hochspringen ↑ C. Kupper: Dietary guidelines and implementation for celiac disease. In: Gastroenterology. 128, Nr. 4 Suppl 1, 2005, S. S121–S127. doi:10.1053/j.gastro.2005.02.024. PMID 15825119.
- ↑ Hochspringen nach: 46,0 46,1 46,2 Isabel Comino, Ana Real, Laura de Lorenzo, Hugh Cornell, Miguel Ángel López-Casado, Francisco Barro, Pedro Lorite, Ma Isabel Torres, Ángel Cebolla, Carolina Sousa: Diversity in oat potential immunogenicity: basis for the selection of oat varieties with no toxicity in coeliac disease. In: Gut. 60, Nr. First Online, 12, S. 915–922. doi:10.1136/gut.2010.225268. PMID 21317420. PMC 3112367 (freier Volltext). Abgerufen am 12. März 2011.
- Hochspringen ↑ R.B. Smith, H. Sprinz, W.H. Crosby, B.H. Sullivan: Peroral small bowel mucosal biopsy. In: Am. J. Med.. 25, Nr. 3, September 1958, S. 391–394. doi:10.1016/0002-9343(58)90077-9. PMID 13571252.
- Hochspringen ↑ K. Garsed, B.B. Scott: Can oats be taken in a gluten-free diet? A systematic review. In: Scand. J. Gastroenterol.. 42, Nr. 2, Februar 2007, S. 171–178. doi:10.1080/00365520600863944. PMID 17327936.
- ↑ Hochspringen nach: 49,0 49,1 American Dietetic Association. Nutrition Care Manual: Celiac Disease. Available at: http://www.nutritioncaremanual.org. Accessed December 15, 2004.
- Hochspringen ↑ Thompson T: Gluten contamination of commercial oat products in the United States. In: N. Engl. J. Med.. 351, Nr. 19, November 2004, S. 2021–2022. doi:10.1056/NEJM200411043511924. PMID 15525734.
- ↑ Hochspringen nach: 51,0 51,1 51,2 A. Hernando, J.R. Mujico, M.C. Mena, M. Lombardía, E. Méndez: Measurement of wheat gluten and barley hordeins in contaminated oats from Europe, the United States and Canada by Sandwich R5 ELISA. In: Eur J Gastroenterol Hepatol. 20, Nr. 6, Juni 2008, S. 545–554. doi:10.1097/MEG.0b013e3282f46597. PMID 18467914.
- Hochspringen ↑ C. Catassi u. a.: A prospective, double-blind, placebo-controlled trial to establish a safe gluten threshold for patients with coeliac disease. In: American Journal of Clinical Nutrition. Vol 85, No 1 2007, S. 160–166.
- Hochspringen ↑ Cleaning/Inspection Process. Gluten Free Oats
- Hochspringen ↑ Are McCann's Oat products gluten free?. Frequently asked questions
- Hochspringen ↑ Gluten free rolled oats. Bob's Red Mill Natural Foods
- Hochspringen ↑ p. 47, Joint FAO/WHO Food Standards Programme Codex Alimentarius Commission, 15th Session Rome, 4–15 July 1983, Report of the 13th Session of the Codex Committee on Foods for Special Dietary Uses (PDF; 565 kB) Bonn-Bad Godesberg, 20–24 September 1982
- Hochspringen ↑ Codex standard for gluten-free foods, CODEX STAN 118-19811. Codex alimentarius, Food and Agricultural Organization of the United Nations
- Hochspringen ↑ Codex Alimentarius Commission, Thirty first Session, Geneva, Switzerland, 30 June – 5 July 2008. Committee on Nutrition and Foods for Special Dietary Uses. Joint FAO/WHO Food Standards Programme Codex Alimentarius Commission. Report of the 29th Session of the Codex Committee on Nutrition and Foods for Special Dietary Uses (PDF; 815 kB)
- ↑ Hochspringen nach: 59,0 59,1 Draft Revised Standard for Foods for Special Dietary Use for Persons intolerant to Gluten (at Step 8). S. 50–51. Committee on Nutrition and Foods for Special Dietary Uses. Joint FAO/WHO Food Standards Programme Codex Alimentarius Commission. Thirty-first Session Geneva, Switzerland, 30 June – 5 July 2008, Codex Alimentarius Commission Report of the 29th Session of the Codex Committee on Nutrition and Foods for Special Dietary Uses (PDF; 815 kB)
- Hochspringen ↑ M. Rashid, D. Butzner, V. Burrows u. a.: Consumption of pure oats by individuals with celiac disease: A position statement by the Canadian Celiac Association. In: Can. J. Gastroenterol.. 21, Nr. 10, Oktober 2007, S. 649–651. PMID 17948135. PMC 2658132 (freier Volltext).
- Hochspringen ↑ S. Størsrud, L.R. Hulthén, R.A. Lenner: Beneficial effects of oats in the gluten-free diet of adults with special reference to nutrient status, symptoms and subjective experiences. In: Br. J. Nutr.. 90, Nr. 1, Juli 2003, S. 101–107. doi:10.1079/BJN2003872. PMID 12844381.
- ↑ Hochspringen nach: 62,0 62,1 Mohsin Rashid: Guidelines for Consumption of Pure and Uncontaminated Oats by Individuals with Celiac Disease. Professional Advisory Board of Canadian Celiac Association. 8. Juni 2007. Abgerufen am 14. August 2008.
| Dieser Artikel behandelt ein Gesundheitsthema. Er dient nicht der Selbstdiagnose und ersetzt keine Arztdiagnose. Bitte hierzu diesen Hinweis zu Gesundheitsthemen in der Wikipedia beachten! |